敲除细胞株构建技术原理:Clustered Regularly Interspaced Short Palindromic Repeats(CRISPR)/Cas9是细菌和古细菌在长期进化而形成的一种适应性免疫防御机制,CRISPR/Cas9系统可以用于各种基因组的编辑。CRISPR/Cas9系统会通过小导向RNA(sgRNA)对切割区域进行识别,并利用Cas9内切酶实现在识别位点中间预测的位置切割,造成DNA双链断裂,在细胞进行易错修复后造成随机的突变。CRISPR/Cas9系统其突变效率高、灵活简单,周期短,成本低,已经被广泛的应用于基因编辑的研究。CRISPR/Cas9系统应用最多的领域是基因敲除株系构建和基因敲除动物的研究。
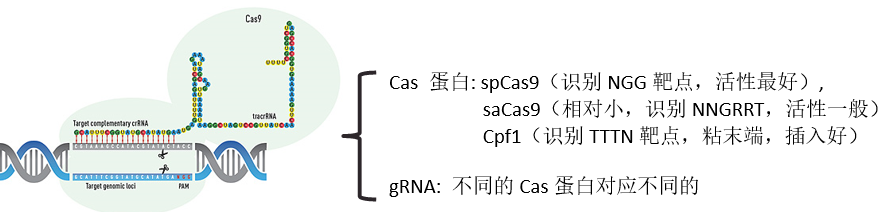
CRISPR/Cas基因组编辑原理可提供项目服务包括:CRISPR/Cas9实验方案设计、CRISPR/Cas9基因敲除载体构建、CRISPR/Cas9基因敲除载体病毒包装、CRISPR/Cas9基因敲除细胞株构建。
服务特点:1.定制特定基因敲除细胞系只需提供基因名称;2.快速获得有效sgRNA,基因编辑效率高;3.实验周期短;4.可根据需要提供CRISPR/Cas9慢病毒包装服务。
操作流程:1.靶向目的序列sgRNA的设计、载体构建及活性验证;2.目的细胞系共转染,初步筛选混合克隆;3.铺单克隆,单克隆筛选及鉴定细胞基因型;4.阳性细胞株的扩增。
双萤光素酶检测
萤光素酶是理想的报告基因,因为哺乳动物细胞中不含内源性萤光素酶,一旦转录完成立刻就生成功能性的萤光素酶。单报告基因实验往往会受到各种实验条件的影响,而双报告基因则通过共转染的“对照”作为内参为试验提供一基准线,从而可以在最大程度上减小细胞活性和转染效率等外在因素对实验的影响,使得数据结果更为可信。Dual-Luciferase®双萤光素酶报告基因检测系统在细胞中同时表达萤火虫萤光素酶和海肾萤光素酶,两者没有种源同源性并对应不同的反应底物,故而没有交叉干扰。得益于超强的光信号和超高的信噪比。
miRNA靶基因验证
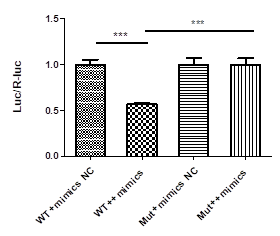
miRNA主要通过作用于靶基因的3’UTR起作用(降解或抑制翻译),将目的基因3’UTR(野生型和结合位点突变型)序列构建至载体中报告基因F-Luc的3’端,通过比较过表达miRNA后,报告基因表达的改变(萤光素酶的活性下降还是不变),来确定miRNA与靶基因3’UTR的作用位点。
目的:验证 miRNA与靶基因3’UTR 是否发生调控作用。
材料:质粒pMIR-REPORT Luciferase基因3'UTR(Wt);pMIR-REPORT Luciferase-基因3'UTR(Mut);pRL-CMV(H321,Promega);293T细胞株
步骤:靶点预测——构建质粒——转染细胞检测——报告基因检测(Luciferase活性检测)——统计分析
结果:
启动子活性研究转录因子是一种具有特殊结构、行使调控基因表达功能的蛋白质分子,也称为反式作用因子。某些转录因子仅与其靶启动子中的特异序列结合,这些特异性的序列被称为顺式因子,转录因子的DNA结合域和顺式因子实现共价结合,从而对基因的表达起抑制或增强的作用。
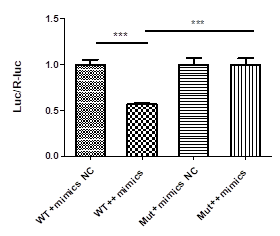
转录因子主要通过作用于靶基因的启动子起作用,将目的基因启动子区序列替换报告基因F-Luc的启动子,通过共表达转录因子后,报告基因表达的改变,来确定转录因子与靶基因启动子结合位点及对靶基因的作用。
目的:检测转录因子对目的基因启动子活性的影响
材料:实验质粒(pGL4.10-基因promotor);对照质粒; pRL-CMV(E2261,Promega);转录因子质粒;293T细胞株
步骤:靶点预测——构建质粒——转染细胞检测——报告基因检测(Luciferase活性检测)——统计分析
结果:
客户需提供信息:1.靶基因名称2.靶基因种属3.调控因子(miRNA或者转录因子)名称提供给客户:1.结合位点预测结果2.质粒及其构建报告3.双荧光素酶检测报告
外源基因在细胞中的表达可分为两大类,一类是瞬时表达,外源DNA/RNA不整合到宿主染色体中,虽然可以达到高水平的表达,但通常只持续几天;一类是稳定表达(构建稳转株),外源DNA整合到宿主细胞染色体上,使宿主细胞可长期表达目的基因。
建立稳定细胞株,基本原理是将外源DNA克隆到具有某种抗性的载体上,载体被转染到宿主细胞并整合到宿主染色体中,用载体中所含的抗性标志进行筛选。最常用的真核表达载体的抗性筛选标志物有新霉素(neomycin)、潮霉素(hygromycin)和嘌呤霉素(puromycin),筛选得到可稳定表达目的蛋白、或稳定沉默特定基因的细胞株。
筛选方法:
慢病毒感染筛选稳定细胞株
利用慢病毒整合表达特性来筛选稳定细胞株,该方法克服了传统质粒挑单克隆方法周期久的弊端,可以在短时间内高效获取稳定细胞株。
利用慢病毒制备稳定株优势:
(1)细胞适用种类广泛,可用于各种哺乳动物细胞;
(2)构建稳转株时间短,表达持续时间长;
(3)多种荧光标记和抗性基因可选,满足观测实验要求。
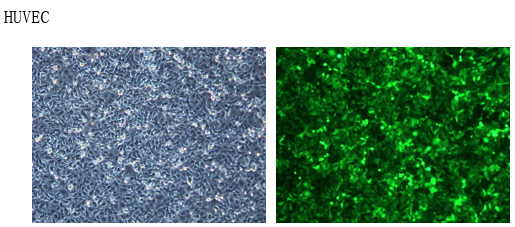
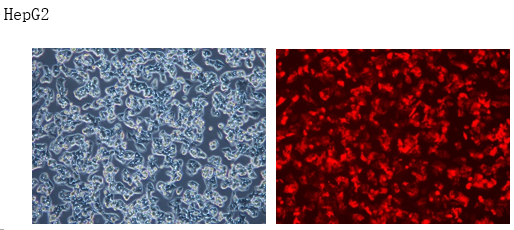
稳定细胞株分类:
混合克隆稳定细胞株
混合克隆细胞系是基因转染后直接用抗药筛选得到的,筛选出的细胞都表达抗性基因和目的基因,但包含了各种不同的细胞克隆。不同克隆的目的基因整合位置和表达量均有所不同。
混合克隆细胞株筛选比较快速,费用较低。在需要构建的细胞株转染效率高,目的基因表达效率高的情况下,单克隆细胞株最后得到的表达效果和混合克隆细胞株并没有显著差异,这时多克隆细胞筛选是理想的选择。
单克隆稳定细胞株
单克隆细胞系是由含有稳定整合外源片段的单个细胞的扩增得到的细胞株,每个细胞的目的基因整合位置的表达量均高度一致,但可能丢失一些表型。单克隆细胞株筛选周期长,费用高。需要进行细胞亚定位实验的细胞系,难感染的和表达率低的通常建议进行单克隆细胞筛选。
服务流程

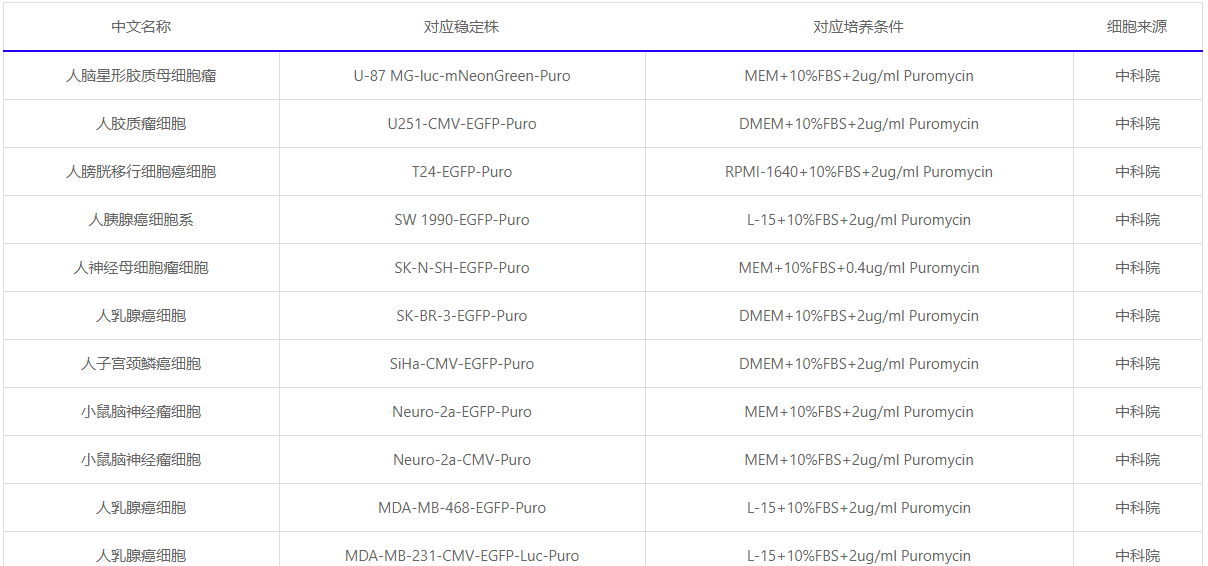
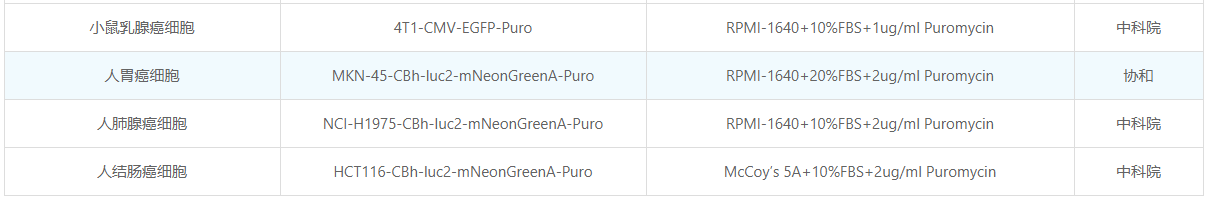
已构建的稳定株列表(部分):

1.细胞增殖
细胞增殖与细胞凋亡、细胞周期等是肿瘤研究的重要表型,是分子生物学和药理学研究解决的问题之一。通过在细胞中过表达或干扰某个基因研究基因对细胞增殖能力的影响,进一步研究基因的功能,或对细胞进行药物处理,研究药物对增殖的影响。
实验原理(CCK-8) 细胞增殖是生物体的重要生命特征,细胞以分裂的方式进行增殖,是生物体生长、发育、繁殖和遗传的基础。细胞增殖的研究方法有很多,主要包括:CCK8/ CellTiter-Glo™等方法。
Cell Counting Kit-8(简称CCK-8)试剂可用于简便而准确的细胞增殖和毒性分析。其基本原理为:该试剂中含有WST-8【化学名:2-(2-甲氧基-4-硝基苯基)-3-(4-硝基苯基)-5-(2,4-二磺酸苯)-2H-四唑单钠盐】,它在电子载体1-甲氧基-5-甲基吩嗪鎓硫酸二甲酯(1-Methoxy PMS)的作用下被细胞中的脱氢酶还原为具有高度水溶性的黄色甲瓒产物(Formazan dye)。生成的甲瓒物的数量与活细胞的数量成正比。因此可利用这一特性直接进行细胞增殖和毒性分析。
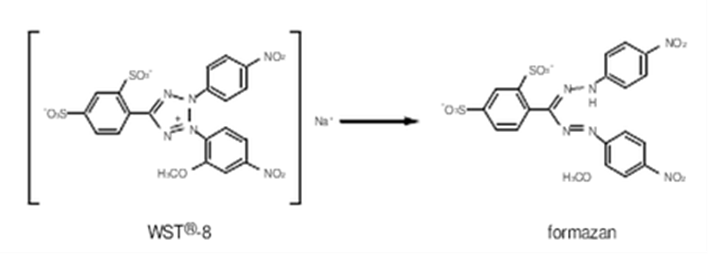
CCK-8方法优势:(1)操作简单,避免细胞计数过程中人为因素的影响;(2)细胞用量少,检测灵敏度高,稳定;(3)可反复用酶标仪读板,检测时间灵活,不影响细胞进行后续实验;(4)CCK-8产生的Formazan是水溶性的,无需换液,尤其适用于悬浮细胞,与MTT法相比更方便,更安全。
目的:考察目的基因对细胞的增殖能力产生的影响或药物对细胞增殖能力的影响
材料:目的细胞、稳转株(空载、目的基因)步骤:细胞收集——细胞铺板——(药物处理)——细胞培养0、6、24、48、72小时后加入CCK-8处理,酶标仪检测
结果:
实验原理(CellTiter-Glo™)
ATP腺嘌呤核苷三磷酸(简称三磷酸腺苷)参与生物体内多种酶促反应,是活细胞新陈代谢的一个指标,其含量直接反应了细胞的数量及细胞状态:实验过程中向细胞培养基加入等体积CellTiter-Glo™试剂,测量发光值,在光信号和体系中,发光值与ATP量成正比,而ATP又和活细胞数正相关,因此可通过检测ATP含量得细胞活力。
CTG方法优势:(1)同普通的MTT、CCK8法相比,CellTiter-Glo™发光活细胞检测系统的检测试剂具有最高灵敏度和较长的信号持续时间,此系统已经广泛地应用在生命科学研究领域中,如一些生物活性因子的活性检测、大规模的抗肿瘤药物筛选、细胞毒性试验以及肿瘤放射敏感性测定等;(2)CellTiter-Glo™试剂和细胞培养中的常用培养基兼容,如RPMI1640、MEM、DMEM和 Ham's F12,也不受酚红和有机溶剂的影响,误差小,准确率高。
目的:考察目的基因对细胞的增殖能力产生的影响或药物对细胞增殖能力的影响
材料:目的细胞步骤:细胞收集——细胞铺板——(药物处理)——细胞培养0、24、48、72、96小时后加入CellTiter-Glo™溶液用微孔板震荡器5分钟,于室温放置10分钟-酶标仪检测荧光值
结果:
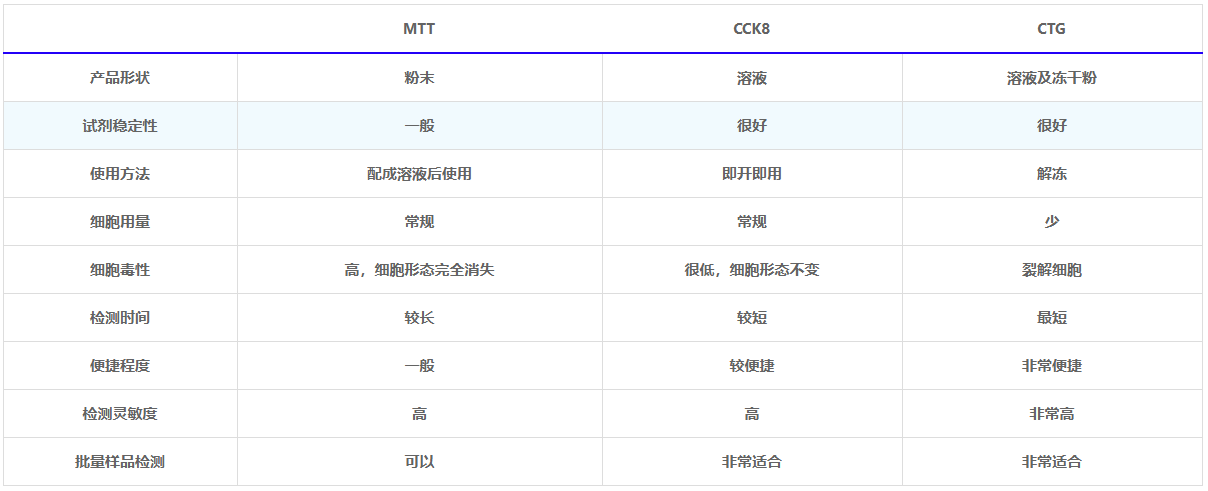
MTT CCK8 CTG 检测方法对比
2 细胞凋亡
细胞凋亡是肿瘤和发育研究的重点,同时也是药理学研究的热点。细胞凋亡是指细胞在一定的生理或病理条件下,遵循自身的程序,自主结束其生命的过程。它是一个主动的,高度有序的,基因控制的,一系列酶参与的过程。细胞凋亡的过程大致可分为以下几个阶段:接受凋亡信号→凋亡调控分子间的相互作用→蛋白水解酶的活化(Caspase)→进入连续反应过程。
基本原理
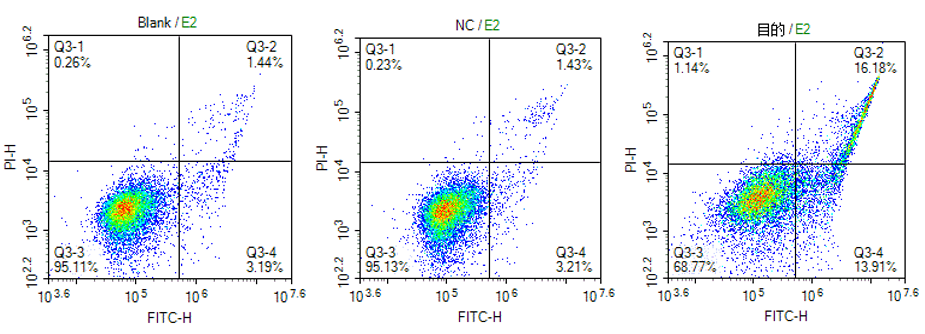
细胞凋亡检测采用Annexin V/PI双染法检测,Annexin V是一种分子量为35~36kD的Ca2+依赖性磷脂结合蛋白,能与磷脂酰丝氨酸(Phosphatidylserine,PS)高亲和力特异性结合。在细胞凋亡的早期,PS可从细胞膜的内侧翻转到细胞膜的表面,暴露在细胞外环境中。将Annexin V 进行荧光素(FITC或PE)或Biotin 标记,以标记了的Annexin V 作为荧光探针,利用流式细胞仪或荧光显微镜可检测细胞凋亡的发生。
7-AAD类似于碘化丙啶(propidine iodide,PI)是一种核酸染料,它不能透过完整的细胞膜,但在凋亡中晚期的细胞和死细胞,7-AAD能够透过细胞膜而使细胞核红染。因此将Annexin V 与7-AAD 匹配使用,就可以将凋亡早晚期的细胞以及死细胞区分开来。
目的: 通过慢病毒感染获得过表达某基因的细胞株,利用Annexin-PE和7-AAD双染法对正常细胞、对照组细胞、基因过表达组细胞的凋亡情况进行检测,研究基因对细胞凋亡的影响。
材料:质粒与细胞株
步骤:细胞准备——收集细胞——Annexin-PE和 7-AAD进行双染色——流式上机检测结果:
3 细胞侵袭和迁移
在肿瘤发展过程中,细胞进入循环系统的能力是重要的研究对象。相关的信号通路主要可以分为控制细胞黏附和控制细胞骨架。细胞的迁移与侵袭主要与细胞骨架和黏附相关。肿瘤细胞侵袭和迁移能力的改变通常采用Transwell进行检测。细胞划痕也是测定肿瘤细胞运动特性的方法,由于无法区别正常增殖和迁移细胞,应用有局限性。
Transwell实验
Transwell小室底层的一张有通透性的膜(一般为聚碳酸酯膜),将其放置于孔板中,小室内称上室,培养板内称下室。由于聚碳酸酯膜有通透性,下层培养液中的成分可以影响到上室内的细胞。应用Transwell可研究下层培养液中的成分对细胞生长、运动等的影响。
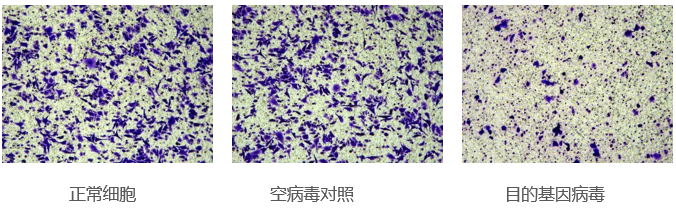
肿瘤迁移实验:研究肿瘤细胞的迁移能力或特定情况下肿瘤细胞的迁移能力。常用8.0、12.0µm膜,上室种肿瘤细胞,下室加入FBS或某些特定的趋化因子,肿瘤细胞会向营养成分高的下室跑,计数进入下室的细胞量可反映肿瘤细胞的迁移能力。
肿瘤侵袭实验:研究肿瘤细胞的侵袭能力或特定情况下肿瘤细胞的侵袭能力。在聚碳酸酯膜上涂上一层基质胶,模仿细胞外基质,上室种肿瘤细胞,下室加入FBS或某些特定的趋化因子,细胞要把基质消化后才可以从上室迁移到下室,计数进入下室的细胞量测定细胞的侵袭能力。
目的: 研究目的基因过表达/干扰对细胞侵袭、转移能力的影响
材料:正常细胞、对照慢病毒、过表达基因慢病毒
步骤:细胞复苏——Transwell铺板——细胞培养及染色——拍照
结果:
划痕实验原理
肿瘤细胞在体外仍具有迁移的能力。细胞划痕法是测定了肿瘤细胞的运动特性的方法之一。其借鉴体外细胞致伤愈合实验模型,在体外培养的单层细胞上,划痕致伤,然后比较不同实验组中肿瘤细胞迁移的能力。
目的: 使用筛选的稳定株(转对照病毒、过表达基因病毒),通过对空细胞、对照稳转、目的基因稳转三组细胞进行划痕宽度进行统计学分析,研究基因对细胞迁移能力的影响。
材料:病毒和细胞株,目的细胞来源于客户,稳定株和元构建
步骤:细胞铺板——划线——细胞培养及拍照——统计分析
结果:

4 细胞周期检测
细胞周期(cell cycle)是指细胞从一次分裂完成开始到下一次分裂结束所经历的全过程,分为间期与分裂期两个阶段。细胞周期反应了细胞增殖速度,单个细胞的周期测定可采用缩时摄影的方法,但它不能代表细胞群体的周期,故现多采用其他方法测群体周期。
基本原理:
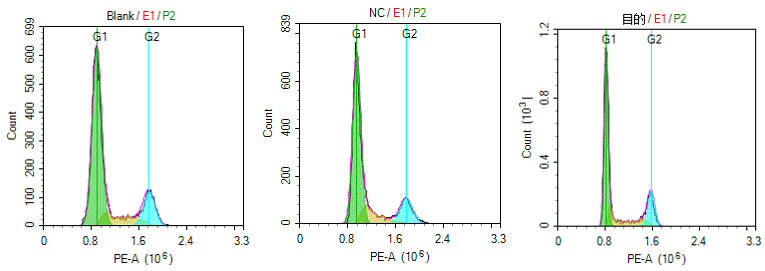
细胞周期各时相的DNA含量不同,通常正常细胞的 G0/G1期具有二倍体细胞的DNA 含量(2N),而G2/M期具有四倍体细胞的DNA含量(4N),而S期的DNA含量介于二倍体和四倍体之间。PI 即碘化丙锭,可以与细胞内DNA 和RNA 结合,采用RNA酶将RNA消化后,通过流式细胞术检测到的与DNA 结合的PI 的荧光强度直接反映了细胞内DNA含量的多少。
因此,通过流式细胞术PI染色法对细胞内DNA含量进行检测时,可以将细胞周期各时相区分为 G0/G1期,S 期和G2/M期,并可通过特殊软件计算各时相的百分率。
目的: 通过慢病毒感染获得基因过表达的细胞株,利用PI染色法结合流式细胞术检测各组细胞周期的变化。从而研究目的基因对细胞周期的影响。
材料:目的细胞、病毒
步骤:细胞准备——样品收集——上机检测——数据分析
结果:
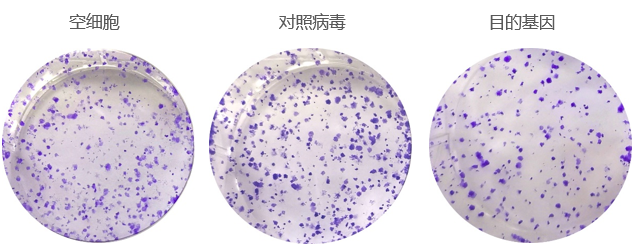
5.克隆形成实验
基本原理:
单个细胞在体外增殖6代以上(时间约1周以上),其后代所形成的细胞群体,称为集落或克隆。每个克隆含有50个以上的细胞,大小在0.3 - 1.0mm之间。细胞接种存活率只表示接种细胞后贴壁的细胞数, 但贴壁后的细胞不一定每个都能增殖并形成克隆。只有同时具有贴壁和增殖活力的细胞才会形成克隆。克隆形成率反映细胞的独立生存能力的强弱,用于评价细胞群体依赖性和增殖能力。由于细胞生物学性状不同,细胞克隆形成率差别也很大,一般初代培养细胞克隆形成率弱,传代细胞系强; 二倍体细胞克隆形成率弱,转化细胞系强;正常细胞克隆形成率弱,肿瘤细胞强。
克隆形成率与接种密度有一定关系,做克隆形成率测定时,接种细胞一定要分散成单细胞悬液,直接接种在培养皿中,持续一周以上,随时检查,到细胞形成克隆时终止培养。
目的:通过目的基因过表达/干扰细胞组、空细胞组与阴性对照组(空病毒)克隆形成数量的统计学分析,研究基因对细胞群体依赖性和增殖能力的影响。
材料:病毒和细胞株
步骤:铺板——细胞培养——观察克隆,染色,计算克隆形成率
结果: